【速報!】 FDAによる初のMASH治療薬承認
2024年3月14日に
業界を驚かせるニュースが舞い込んできました。
United States Food and Drug Administration (FDA)はMASHに対する初めての治療薬としてMadrigal Pharmaceuticalsが開発を行ったRezdiffra (resmetirom)の承認を発表しました。
FDAが初のMASH治療法を承認
これまで治療方法がなかった疾患に対し治療薬が承認されたことを、心から嬉しく思います。
もしお客様がこの状況下において、MASH治療薬を開発されている場合STAMTM-HCC/IO+モデルを利用することで、化合物の効果を最大限評価することが可能です。
上述の通り、RezdiffraがMASH治療薬として承認されたものの、臨床試験の結果によると少なくとも半数のMASH患者では病態の改善が認められていません。
これはMASHという疾患のメカニズムの複雑さによるものと考えられ、これまで治療薬開発が成功しなかった理由の一つです。
STAMTM-HCC/IO+モデルはMASHで生じる複雑な病態を反映しているモデルとして様々な経路の化合物の評価が行われ、臨床試験に進んでいる化合物も多く存在します。
以下の図ではPhase 2以降の臨床試験が実施されている化合物とそのターゲットを示しています。
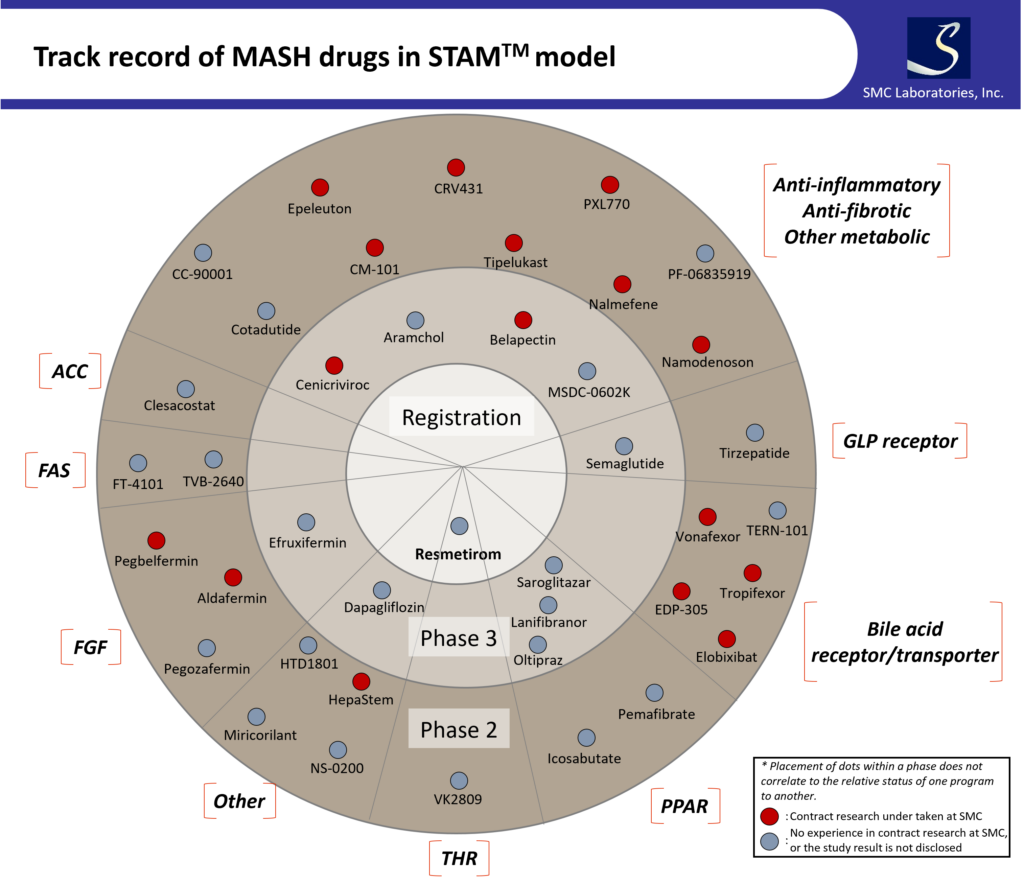
上記の図で分かるように、STAMTM-HCC/IO+モデルは、MASHで見られる複雑な病態を再現し様々なターゲットが評価可能なモデルです。
複雑な病態を再現するこのモデルの利用によりお客様の化合物を評価すると共にRezdiffraとの複合投与による治療効果を評価することも可能となります。
STAMTM-HCC/IO+モデルではこれまでも化合物の複合投与試験の経験があり、相乗効果が見られることが確認されています。
STAMTM-HCC/IO+モデルを用いて、800以上の薬効評価試験を実施し、膨大なノウハウを有している私たちであれば、お客様に最適なご提案が可能です。
今回の歴史的ニュースは今後の研究の発展の第一歩となると思います。
このニュースに刺激を受け現在行っている評価試験から第2、第3の承認がでるよう一層邁進していきたいと思っております。
今回の承認に続く結果をお客様の研究でもお力添えができれば嬉しく思います。
この機会にぜひ、私たちにご連絡ください。